Jest zdjęcie LaDonna Lopossa, które pomaga opowiedzieć tę historię. Ona się uśmiecha, leżąc na trawie w niejasny sposób Betty Grable na szczycie własnej cmentarnej działki. Portret był pomysłem jej męża - wydaje się, że przez całe dziesięciolecia George, znany również jako Pan No Serious, nigdy nie widział kneblowania, którego nie lubił - ale to LaDonna wymyśliła sernik.
powiązana zawartość
- Duże nadzieje na nowy rodzaj genów
- „Tajni Żydzi” z San Luis Valley
„OK” - powiedział George - „teraz zdejmij koszulę”.
"Jerzy!"
Kliknij.
Z jednej strony jest to głupia migawka 60-letniej kobiety w swetrze i rozsądnych sandałach w Winlock w Waszyngtonie, pewnego słonecznego dnia w maju 2000 r. Z drugiej strony jest to przebłysk możliwej przyszłości, w której nauka rozwiązała się przerażający problem. Bo w ten sposób LaDonna i George zmierzyli się z jej śmiertelnym rakiem, nie tylko gwiżdżąc obok cmentarza, ale klaunując w jego środku.
Trzy miesiące wcześniej LaDonna leżała na szpitalnym łóżku w Olimpii, żeby narysować zasłonę. Było wiele rzeczy do stracenia: czworo dorosłych dzieci, kilku wnuków, przyjaciół w kościele, dobre małżeństwo. (Nieważne, że kiedy tam leżała, George głośno mówił pielęgniarkom, że uderzy w kraty, by znaleźć inną żonę, co rozumiała jako jego dziwny wysiłek, aby uspokoić umysł.) Była gotowa opuścić wszystkich i wszystkie te rzeczy i więcej z powodu bólu.
Jej śledziona, zwykle schowana pod najniższym lewym żebrem i nie większa niż brzoskwinia, była tak wypełniona białymi krwinkami, że była wielkości kantalupa. Ledwo mogła chodzić. Jej skóra była upiorna, krew niebezpiecznie pozbawiona czerwonych krwinek. Oddychanie było obowiązkiem. Regularne wymioty Przeszywający ból głęboko w kościach, gdzie szpik gorączkowo wyrywa białe komórki lub leukocyty. Powtarzające się gorączki. I zimno, dziwnie, niepokojąco zimno : zamarzała pod szpitalnymi kocami.
Była za stara i zbyt chora, aby przejść przeszczep szpiku kostnego, wyczerpujące, bardzo ryzykowne leczenie raka krwi, przewlekłej białaczki szpikowej (CML). Próbowała już innego standardowego leczenia CML, regularnych dawek silnego związku interferonu. Ale to tak nasiliło jej nudności, gorączkę i ból kości, że porzuciła leki, chodź co może. Ponieważ w ich arsenale zwalczającym białaczkę nie pozostało nic, lekarze sprowadzili się do Dilaudida, pochodnej morfiny, narkotycznego środka przeciwbólowego. Było uspokajająco, pocieszająco i dla pacjenta w jej stanie był to oczywiście koniec.
George oddał większość jej rzeczy i zarezerwował ciężarówkę U-Haul, aby przewozić swoje rzeczy do Południowej Kalifornii, gdzie zamieszka z jednym z ich synów. Wybrano muzykę na jej pogrzeb, w tym utwór „Ponieważ wiele mi zostało”, zaśpiewany przez wnuków. Kiedy szpital zalecił przeniesienie LaDonna do hospicjum, George zamiast tego zabrał ją do domu i zastosował się do porady lekarza, aby wezwać dzieci; Terry, Darren i Stephen przylecieli z okolic Los Angeles, a Kelly odjechała ze swojego miejsca w Winlock. Po kolei weszli do sypialni, usiedli przy łóżku LaDonna i pożegnali się.
CML jest jednym z czterech głównych rodzajów białaczki u dorosłych, ale nie jest powszechny, co roku uderza w 5000 ludzi w Stanach Zjednoczonych. Z reguły jest to śmiertelne, ponieważ większość pacjentów umiera w ciągu pięciu lat od zdiagnozowania. Pierwsza faza, podstępna eksplozja normalnie białych krwinek, może trwać miesiące lub lata; pacjenci są często powiadamiani o tym rutynowym badaniu krwi. Jeśli choroba nie zostanie skontrolowana, białe krwinki stają się coraz bardziej nienormalne, wydzielając hel-skelter z poszczególnych komórek macierzystych w szpiku kostnym zwanych komórkami mieloidalnymi; takie leukocyty rozrywają naczynia włosowate, przytłaczają narządy i duszą tkanki przez wypychanie czerwonych krwinek przenoszących tlen. Lekarze twierdzą, że przebieg choroby jest wyjątkowo przewidywalny, ale jej mechaniczna natura dała również naukowcom szansę: wtrącając się w molekularne koła zębate i sprężyny napędzające CML, rozumieją ją lepiej niż jakikolwiek inny rak.
Pewnego razu na początku grudnia 1999 r. George jechał do LaDonna do szpitala w Olimpii i zatrzymał się na drodze do Safeway, aby kupić gazetę. Pan No Serious jest zapalonym czytelnikiem, prowadził nawet na krótko księgarnię z LaDonna i pożarł gazetę w jej szpitalnej sali. Tak się złożyło, że eksperymentalne leczenie białaczki znalazło się na pierwszych stronach gazet. „Leukemia Pill Holds Promise”, donosi Associated Press, mówiąc, że pacjenci z CML „mieli prawidłową liczbę krwinek w ciągu miesiąca od rozpoczęcia leczenia”. Badanie zostało następnie rozpoczęte na Oregon Health & Science University (OHSU) w Portland.
George wybiegł z sali szpitalnej, by znaleźć onkologa LaDonny.
Cel interwencji
Stroma, kręta, wysadzana drzewami droga prowadzi do głównego kampusu, który znajduje się w pobliżu szczytu wzgórza Marquam o wysokości 574 stóp, aw mgliste dni wydaje się unosić nad miastem jak zamek w bajce. Kolejną drogą do OHSU jest powietrzny tramwaj portowy: dwa szwajcarskie samochody gondolowe z błyszczącej stali szybują na kablach wysoko nad autostradą międzystanową nr 5, śmigając w tę iz powrotem między zachodnim brzegiem rzeki Willamette a platformą szpitalną położoną bliżej krawędzi klifu, niż pacjenci wysiadający z serca mogą sobie tego życzyć.
Brian Druker przybył do OHSU w 1993 roku, na wiele lat przed zbudowaniem tramwaju, a fresk z sławą w sąsiednim przejściu zawierał jego zdjęcie. Wysoki, chudy i chudy jak chart, miękki mówca, Druker miał 38 lat i właśnie spędził dziewięć lat w Dana-Farber Cancer Institute, część Harvard Medical School w Bostonie. „Widziałem raka jako możliwy do rozwiązania problem”, przypomniał sobie ścieżkę badawczą, którą wybrał po ukończeniu szkoły medycznej na Uniwersytecie Kalifornijskim w San Diego. „Ludzie zaczęli otrzymywać wskazówki i wskazówki, a ja po prostu wydawało mi się, że w moim życiu prawdopodobnie ulegnie ono nauce i odkryciom”.
W Dana-Farber Druker wylądował w laboratorium, badając, jak normalna ludzka komórka powoduje niekontrolowany wzrost - złośliwość. Laboratorium skupiło się między innymi na enzymach, białkach, które zmieniają inne cząsteczki, rozkładając je (np. Enzymy jelitowe, pomagają trawić żywność) lub łącząc je (enzymy mieszków włosowych konstruują jedwabiste włókna keratynowe). Enzymy biorą również udział w reakcjach łańcuchowych, przy czym jeden enzym aktywuje inny i tak dalej, aż do osiągnięcia złożonego wyczynu komórkowego; w ten sposób komórka może kontrolować proces, taki jak wzrost lub podział, inicjując pojedynczą reakcję, taką jak przechylenie pierwszego domina. Pod kierownictwem laboratorium, Thomas Roberts, Druker opanował wiele technik śledzenia i pomiaru enzymów w próbkach tkanek, ostatecznie przekształcając się w jedną z nich zaangażowaną w CML.
Opracowanie szczegółów, dlaczego ten konkretny enzym jest kluczem do CML, wymagało zaangażowania setek naukowców z całego świata - badań, które doprowadziłyby do kilku nagród Nobla - ale w zasadzie to tutaj rozpoczął Druker:
Po pierwsze, wszyscy pacjenci z CML mają enzym renegatów w białych krwinkach.
Po drugie, sam enzym jest produktem dziwacznego genu, zwanego BCR-ABL, utworzonego podczas podziału pojedynczej szpikowej komórki macierzystej, a następnie przekazanego miliardom potomków: wierzchołki dwóch chromosomów, te wrzecionowate struktury przechowujące DNA, faktycznie zamieniają się miejscami, powodując połączenie oddzielonych genów zwanych BCR i ABL (patrz ilustracja). Nowy zmutowany gen BCR-ABL znajduje się na osobliwym chromosomie odkrytym w 1960 r. Przez naukowców z University of Pennsylvania. Ten „chromosom Philadelphia” widoczny przez mikroskop jest znakiem rozpoznawczym CML.
Po trzecie, enzym BCR-ABL jest złym bliźniakiem normalnego enzymu, który pomaga kontrolować produkcję białych krwinek. Ale jak przełącznik zablokowany w pozycji „włączony”, mutant pobudza dziką proliferację, jaką jest białaczka.
Nie musiałeś być lekarzem z Harvardu, aby zobaczyć, że pojedynczy enzym powodujący śmiertelną białaczkę był, jak twierdzą naukowcy, atrakcyjnym celem interwencji. I rzeczywiście naukowcy postanowili znaleźć lub wynaleźć związki, które mogłyby blokować enzym BCR-ABL.
Druker i jego współpracownicy z Bostonu, używając specjalnie zaprojektowanych przeciwciał, opracowali nowy sposób pomiaru aktywności enzymu - narzędzie, które okaże się nieocenione przy ocenie potencjalnych metod leczenia CML. Druker, lekarz noszący krawat wśród doktorów w dżinsach, ścigał się z konkurentami w innych ośrodkach badawczych, aby znaleźć lek hamujący raka poprzez wyłączenie enzymu o kluczowym znaczeniu i oszczędzający zdrowe tkanki w okazyjnej cenie. Zgodnie z tradycją metody leczenia raka bombardują ciało silnymi lekami, zabijając zarówno zdrowe, jak i rakowe komórki - „chemioterapię cytotoksyczną”, jak nazywają to lekarze. Alternatywna terapia celowana lepiej zwalczałaby raka przy mniejszym uszkodzeniu ubocznym, a przynajmniej takie było pojęcie, które często trzymało Drukera w laboratorium do 23:00
Potem wszystko zaczęło się rozpadać. „Moje małżeństwo się rozpadło. Nie byłem tym, co nazwałbyś oddanym mężem. Byłem oddanym badaczem, naukowcem i lekarzem. I to odbiło się na skutkach. ”(Druker i jego żona rozstali się po dwóch latach małżeństwa, a później rozwiedli się).
Mimo to, mając do dyspozycji wiele opublikowanych badań i sprytną technikę pomiaru enzymów, która pokazała jego wysiłki, Druker pomyślał, że jest gotowy na przejście po drabinie Harvarda od instruktora do asystenta profesora. „Usiadłem z szefem onkologii medycznej w Dana-Farber” - wspomina Druker. „Przejrzał moje CV i powiedział:„ Po prostu nie sądzę, żeby ta praca nigdzie się tutaj trafiła ”. Tłumaczenie:„ Powiedziano mi, że nie mam przyszłości w Dana-Farber ”.
„To było okropne” - wspominał. "Miałem depresję. Ale zmusiło mnie to do powiedzenia: Czy wierzę w siebie? Mam zamiar to zrobić, zrobić różnicę?
Rosnące obawy
Jeden z naukowców poproszony o opisanie podejścia Drukera powiedział, że „sprowadza się on do„ wytrwałości i uporu w rezygnowaniu z pomysłu ”.
„Myślę, że sam w sobie jest nieśmiałym człowiekiem”, powiedział inny. „Ale w tej” - terapii rakowej - „jest jak krzyżowiec”.
„Bierze wszystko, co skomplikowane, zapamiętuje to i przedstawia najprostszą możliwą interpretację i interwencję.”
„Kiedy zadajesz pytanie, w pokoju panuje cisza, prawie niewygodna cisza, a ty jakbyś mnie słyszał? Zastanawia się, zanim udzieli odpowiedzi.
„Pozwala naukom mówić”.
Druker dorastał najmłodszym z czworga dzieci w St. Paul w stanie Minnesota i uczęszczał do szkół publicznych, specjalizując się w matematyce i naukach ścisłych. Jego ojciec był chemikiem w 3M, którego praca nad procesami drukowania została opatentowana. Jego matka była gospodynią domową, która zaangażowała się w politykę rady szkolnej i bezskutecznie ubiegała się o władzę stanową. Po ukończeniu chemii na Uniwersytecie Kalifornijskim w San Diego pozostał, aw 1978 roku, w pierwszym roku studiów medycznych, napisał 16-stronicowy artykuł, w którym zasugerował przyszłość, którą mógłby stworzyć. Napisany odręcznie niebieskim tuszem na papierze zeszytowym i zatytułowany „Chemioterapia raka”, stwierdził, że pewnego dnia, gdy działanie leków przeciwnowotworowych jest „rozumiane w kategoriach biochemicznych, dziedzina chemioterapii raka powinna robić postępy znacznie wykraczające poza dotychczasowe postępy. ”
Po tym, jak Dana-Farber Cancer Institute rzucił mu pośpiech, Druker zebrał nowe postanowienie. „Kiedy przeprowadziłem się tutaj do Oregonu, moim celem było zidentyfikowanie firmy farmaceutycznej, która miała lek na CML i wprowadzenie go do kliniki” - powiedział.
Wcześniej poznał Nicka Lydona, biochemika w szwajcarskiej firmie farmaceutycznej Ciba-Geigy (która połączyła się z Sandozem w 1996 roku, tworząc Novartis). Lydon współpracował z Robertsem, byłym szefem laboratorium Drukera. „Zadzwoniłem do mojego przyjaciela Nicka z Ciba-Geigy, a on powiedział:„ Mamy to, czego szukasz ”. Nazywało się to STI571. Chemicy z firmy zsyntetyzowali go i inne związki, szukając nowego leku przeciwzapalnego, ale dowiedzieli się, że może on również blokować aktywność enzymów w probówce. Mimo to nie do końca zdecydowali, co zrobić ze związkiem.
W sierpniu 1993 r. Druker otrzymał pierwszą partię płynnego STI571 i innego kandydującego związku ze Szwajcarii. Za pomocą narzędzia do pomiaru enzymów, któremu pomógł opracować, potwierdził, że STI571 silnie hamuje enzym BCR-ABL, który należy do klasy enzymów znanych jako kinazy tyrozynowe; drugi związek zrobił to tylko słabo. Wlał również niewielkie ilości STI571 do tacy pojemników wielkości gilzy, które zawierały płynne i żywe białe krwinki pochodzące od pacjenta z CML. Druker miał nadzieję, że wzrost komórek spowolni lub zatrzyma się. Co więcej, komórki umarły. Ponadto duża ilość STI571 podawana zdrowym komórkom w naczyniu nie wyrządziła szkody. „Wkład Briana był kluczowy” - przypomniał sobie Lydon, przekonując firmę do „pójścia w tym kierunku”.
Ale, oczywiście, droga do zawiedzionych nadziei jest wybrukowana eksperymentalnymi lekami, które wyglądały wspaniale w probówce, ale zawiodły u ludzi. Sceptycy zwrócili uwagę, że w organizmie działają setki różnych rodzajów enzymów kinazy tyrozynowej i, dodali, czy lek, który je zablokował, nie blokuje również wielu innych i nie spowoduje spustoszenia fizjologicznego? „Było wielu naysayers, którzy twierdzili, że niemożliwe byłoby opracowanie specyficznych inhibitorów kinazy białkowej” do leczenia raka, Tony Hunter, biochemik z Salk Institute w La Jolla, Kalifornia, napisał w Journal of Clinical Investigation .
Pomysły naukowe nie zakorzeniają się jak nasiona mniszka lekarskiego wrzucane na żyzny grunt. Potrzebują zwolenników, ludzi, którzy chcą wygrać . Drukarka odłączyła się, wykonując więcej eksperymentów, takich jak indukowanie formy CML u myszy laboratoryjnych i poddawanie ich STI571. To prawie całkowicie wyeliminowało chorobę zwierząt. „Włożyłem prawdopodobnie od 60 do 80 godzin tygodniowo”, przypomniał Druker, który w swoim skromnym wolnym czasie brał udział w wyścigach rowerowych, w sporcie, który wymaga wysokiej tolerancji na ból i wyczucia momentu, w którym powinien wyjść z paczki. „Moje życie w tamtych czasach polegało na tym, że pracowałem [w laboratorium], ćwiczyłem, jadłem i spałem”. Powiedział, że tym, co go napędzało, byli umierający pacjenci z CML.
W 1997 r., Po opublikowaniu licznych badań ze współpracownikami w Portland i Szwajcarii, Druker uznał, że związek jest gotowy do wypróbowania na ludziach. Novartis się nie zgodził. Po pierwsze, gdy psy otrzymywały lek w postaci dożylnej, zwykle powodowały zakrzepy na końcu cewnika. Chemicy Novartis spędzili miesiące przeformułowując płynny lek jako pigułkę. Ale kiedy naukowcy podawali psom duże dawki, zwierzęta wykazywały oznaki uszkodzenia wątroby. Druker przypomniał, że niektórzy urzędnicy firmy całkowicie zrezygnowali z projektu.
Ale uszkodzenie wątroby psa nie zraziło go; chemioterapia jest w końcu destrukcyjna. „Wiedzieliśmy, jak podawać ludziom toksyczne leki przeciwnowotworowe” - powiedział.
Następną rzeczą, którą Druker nie mógł być nielegalny, ale z pewnością nie była koszerna. Ominął Novartis i poszedł prosto do Agencji ds. Żywności i Leków, aby sprawdzić, czy zgromadził wystarczającą ilość danych, aby rozpocząć badanie na ludziach. „Zadzwoniłem do toksykologa z FDA i powiedziałem:„ Oto problem ”. I powiedział: „Mój Boże, masz mnóstwo danych, prawdopodobnie zaakceptowalibyśmy tę aplikację”. Druker powiedział Novartisowi, co zrobił. „Dostałem się do gorącej wody, bo poszedłem za ich plecami.”
Wreszcie, w czerwcu 1998 r., Za zgodą FDA, Druker podał STI571 człowiekowi, 68-letniemu człowiekowi z Oregonu z CML. „To było prawie antyklimatyczne” - wspominał Druker - „ponieważ byliśmy gotowi w listopadzie 1996 r., A tutaj było to ponad półtora roku później”.
Zrekrutował dwóch wybitnych onkologów do pomocy w przeprowadzeniu badania klinicznego, Moshe Talpaz w MD Anderson Cancer Center w Houston i Charles Sawyers w UCLA. Wszyscy pacjenci z CML włączeni do trzech miast przeszli terapię interferonem i albo się nie poprawili, albo nawrócili. Żaden nie kwalifikował się do przeszczepu szpiku kostnego.
Stopniowo zwiększając dawkę STI571, lekarze zaobserwowali przez około sześć miesięcy, że astronomiczna liczba białych krwinek wynosząca prawie 100 000 komórek na milimetr sześcienny spada do mniej niż 10 000, czyli w granicach normy. Analiza białych krwinek jednego z pierwszych pacjentów nie wykazała żadnych oznak chromosomu Philadelphia, co sugeruje, że u źródła zatrzymano białaczkę. Co bardziej imponujące, wszelkie ślady genu BCR-ABL przestały się kopiować. „Wtedy dowiedzieliśmy się, że mamy coś, czego nigdy wcześniej nie widziano w terapii przeciwnowotworowej” - powiedział Druker.
W miarę jak rozeszła się wiadomość w Internecie, inni pacjenci z CML chcieli. Druker naciskał na Novartis, aby wyprodukował więcej leku. Ale Novartis nie był gotowy. Trudno było wyprodukować ten narkotyk, Daniel Vasella, ówczesny dyrektor generalny Novartis, a teraz prezes zarządu, przypomniał sobie w swojej książce o leku Magic Cancer Bullet . „Nie był też [lekiem] o wysokim priorytecie, biorąc pod uwagę niewielką liczbę pacjentów z CML”, dodał. Ponadto udowodnienie, że jest ono zarówno bezpieczne, jak i skuteczne, wymagałoby znacznych inwestycji. „Ciężki efekt uboczny może wystąpić u jednego na 1000 pacjentów i to byłby koniec próby” - napisał.
We wrześniu 1999 r. Druker otrzymał wiadomość e-mail od 33-letniego pacjenta z CML w Montrealu, Suzan McNamara. Była na interferonie, który tłumił jej chorobę przez prawie rok, ale teraz ryczał z powrotem i chciała dołączyć do próby STI571. „Byłam chora do tego stopnia, że ledwo mogłam opuścić dom” - przypomniała mi.
Druker zadzwonił do niej następnego dnia i powiedział, że miną miesiące, zanim będzie mogła zapisać się na badanie - Novartis nie zobowiązał się do wyprodukowania większej ilości STI571. Dodał jednak, że firma może działać szybciej, jeśli usłyszy bezpośrednio od pacjentów.
McNamara i przyjaciel użyli strony internetowej, aby stworzyć petycję z prośbą o szersze udostępnienie leku; poparły to tysiące pacjentów z CML. Wysłała go do Vaselli z listem mówiącym: „Z rosnącym niepokojem widzieliśmy nasze przekonanie ... że podaż leku nie była wystarczająca, aby rozszerzyć badania tak szybko, jak uzasadniają to dotychczasowe dowody”.
„Tego listu nie można zignorować”, powiedziała Vasella. Firma zwiększyła produkcję STI571.
Zaszczyt ogłaszania wczesnych wyników klinicznych przypadł Drukerowi. W Nowym Orleanie 3 grudnia 1999 r. Powiedział audytorium pełnemu hematologom, że wszyscy 31 pacjentów w badaniu pozytywnie zareagowali na STI571, a liczba białych krwinek 30 spadła do normy w ciągu miesiąca. Skutki uboczne pigułki - rozstrój żołądka, skurcze mięśni - to, co onkolodzy nazywają „łagodnym do umiarkowanego”. Druker mówi, że nie pamięta owacji na stojąco.
Odkrycia były „spełnieniem marzeń onkologa molekularnego”, napisał Harold Varmus, który obecnie kieruje National Cancer Institute i otrzymał Nagrodę Nobla za badania, które położyły podwaliny pod sukces STI571. Lek ten, wspomina w swojej książce z 2009 r., The Art and Politics of Science, był „najlepszym jak dotąd dowodem na to, że najbardziej podstawowe aspekty badań nad rakiem przyniosły dramatyczne korzyści pacjentom z rakiem”.
CNN, New York Times, „Good Morning America” i Associated Press opisały przełomową pigułkę na raka.
Fala przyszłości
Po tym, jak LaDonna Lopossa i jej dzieci pożegnały się w lutym 2000 r., Spędziła jeszcze kilka dni i umówiła się na spotkanie w OHSU. Onkologowi LaDonny i Georgeowi udało się wprowadzić ją w drugą fazę badania STI571, w którym zapisano by około 500 nowych pacjentów w kilkunastu centrach medycznych na całym świecie. Wśliznęła się do kliniki na ramieniu George'a. „W co się wplątaliśmy?”, Powiedziała jedna z pielęgniarek, co oznacza, że śmierć LaDonna, która wydawała się nieuchronna, liczyłaby się jako czarny ślad przeciw narkotykowi. Jej biała liczba krwinek przekroczyła 200 000, ponad 20 razy więcej niż normalnie. „Nie było na to dwóch sposobów” - powiedział Druker. „Spojrzałeś na nią, a ona miała kłopoty”.
Przebadali ją i podali jej pigułkę STI571. Ona zwymiotowała.
Następnego ranka George i LaDonna obudzili się w mieszkaniu swojej siostry w Portland, a George zrobił LaDonna koktajl bananowy. Później tego samego dnia pigułka STI571 pozostała. I następny i tak dalej.
„W ciągu trzech tygodni jej śledziona wróciła do stanu normalnego” - powiedział Druker. „Czuła się świetnie. Liczba białych spadła. Efekt podobny do Łazarza. To było naprawdę cudowne. ”
W maju tego samego roku LaDonna i George odwiedzili cmentarz w Winlock, aby złożyć kwiaty na grobie swojej matki, który znajduje się obok działki, którą LaDonna kupiła dla siebie. „Powinienem być w tym grobie”, powiedziała do George'a.
„Cóż”, powiedział, „skoro nie jesteś, dlaczego nie zrobimy zdjęcia?”
Późną zimą 2001 roku Druker i jego współpracownicy zgromadzili większość danych STI571: u około 95 procent pacjentów poziom białych krwinek wrócił do normy, a u 60 procent chromosom Philadelphia nie został wykryty. Firma przedłożyła wyniki FDA z wnioskiem o nowy lek, który zatwierdził za dwa i pół miesiąca - do dziś najszybszy przegląd leków w historii agencji.
Dziesięć lat temu w tym miesiącu rząd USA ogłosił, że lek, który Novartis nazwał Gleevec na rynku północnoamerykańskim (Glivec w Europie), będzie dostępny dla pacjentów z CML. To był decydujący moment. Poprzedni wiek leczenia raka - z przerwami udany, oparty na testach metodą prób i błędów, prawie zawsze bolesny - był znany ekspertom jako „przed Gleeveciem”. Odtąd był „po Gleevecu”, erze terapii celowanej. Na konferencji prasowej w Waszyngtonie, 10 maja, Sekretarz Zdrowia i Opieki Społecznej, Tommy Thompson, nazwał lek „przełomem” i „falą przyszłości”. Ówczesny dyrektor National Cancer Institute, Richard Klausner, opisał to jako „obraz przyszłości leczenia raka”.
Dzisiaj Suzan McNamara zgodzi się, że przyszłość jest dobra. Kiedy po raz pierwszy pojechała do Portland w 2000 roku, aby wziąć udział w badaniu Gleevca, przypomniała sobie: „Pojechałam tam z połową włosów i byłam anoreksyjna i nie mogłam nawet wejść po schodach. Wróciłem za półtora miesiąca, o 20 funtów cięższy i pełen życia ”. Kolejnym krokiem było uczęszczanie na Uniwersytet McGill, studiowanie terapii białaczki i uzyskanie doktoratu z medycyny eksperymentalnej. Teraz 44 lata, mieszka w Montrealu i pracuje w Ottawie dla agencji rządowej Health Canada. Wciąż na Gleevcu biegnie kilka kilometrów kilka razy w tygodniu. „Poszłabym bardziej, gdybym nie był taki leniwy”, powiedziała. W styczniu 2010 roku poślubiła swojego długoletniego chłopaka, Dereka Tahamonta na Hawajach. „Stał przy mnie przez całą chorobę i przez wszystko” - powiedziała. „Zdecydowaliśmy się wskoczyć do samolotu i wziąć ślub na plaży, tylko nas dwoje. To było idealne. ”
Gleevec zachęca ludzi do myślenia, że rak nie zawsze jest śmiertelnym najeźdźcą, którego należy unicestwić, ale przewlekłą dolegliwością, którą można leczyć, jak cukrzyca. W dalszych badaniach prowadzonych przez Druker około 90 procent nowo zdiagnozowanych pacjentów z CML, którzy rozpoczęli przyjmowanie leku Gleevec, przeżyło pięć lat. „Mówię pacjentom, jak optymistycznie patrzę na ich przyszłość” - powiedział Druker. „Przewidujemy dla Gleevca, że średni czas przeżycia wyniesie 30 lat. Ktoś, kto zostanie zdiagnozowany w wieku 60 lat, może dożyć 90 lat i umrzeć na coś innego. ”
Kiedy LaDonna Lopossa miała 60 lat, przypomniała sobie, Druker powiedział, że utrzyma ją przy życiu, dopóki nie będzie miała 70 lat. Potem osiągnęła ten kamień milowy. „Miałem na myśli, kiedy skończyłem 70 lat”, żartował wtedy do niej.
LaDonna, obecnie 71 lat, i George, 68 lat, mieszkają w Battle Ground w Waszyngtonie, wiejskim mieście 24 mil na północ od OHSU, gdzie LaDonna pozostaje pod opieką Drukera. Lopossowie mieszkają w domku w subsydiowanym przez państwo kompleksie mieszkaniowym dla seniorów po drugiej stronie ulicy od rodziny, która trzyma kury na podwórku i pozwala George'owi uprawiać zioła. Ramowa reklama magazynu Gleevec z LaDonna wisi na ścianie salonu. Dwa portrety Chrystusa zdobią ścianę jadalni. George, który szybko mówi, że nie jest religijny - „nikt nie wie, jak Jezus wyglądał”, żartował z ikonografii LaDonny - ma swoją własną jaskinię, w której ogląda „Family Guy”.
LaDonna jest wolontariuszem w North Food Community Bank Bank na ulicy, w kościele w Mormon, do którego należy, i telefonicznie doradza osobom, u których niedawno zdiagnozowano CML w Towarzystwie Leukemii i Chłoniaków. Powiedziała, że jednym z jej największych wyzwań jest przekonanie pacjentów do dalszego przyjmowania leku Gleevec; nie znoszą objawów piorunującego CML, a niektórzy uważają, że skutki uboczne leku są denerwujące.
Gleevec utrzymywała CML LaDonna na dystans przez siedem lat, kiedy to jej choroba stała się oporna na lek. Na szczęście naukowcy medyczni i firmy farmaceutyczne opracowały dwa nowe leki CML, z których każdy wyłącza enzym BCR-ABL w inny sposób i kompensuje pewien rodzaj oporności na Gleevec. Sprycel nie pomógł LaDonna, ale Tasigna zrobiła to - przez około dwa lata. Teraz bierze czwarty celowany lek CML, bosutynib, który wciąż jest eksperymentalny. „Jej białaczka jest najlepiej kontrolowaną, jaką kiedykolwiek miała, odkąd opiekowałem się nią przez ostatnie 11 lat”, powiedział Druker.
Spersonalizowana Onkologia
Druker, siedzący przy małym okrągłym stole konferencyjnym w swoim małym narożnym biurze wysoko na Marquam Hill, powiedział, że nadal studiuje CML, mając nadzieję, że zrozumie, jak wyeliminować każdą ostatnią zmutowaną komórkę macierzystą, a także próbował zastosować „paradygmat Gleevec” do inne białaczki. Na ścianie wisiała jasnożółta koszulka wyścigowa noszona i opatrzona autografem mistrza Tour de France i ocalałego z raka, Lance'a Armstronga. Był pogodny dzień i przez okno wychodzące na północ widać było wielką waniliową gałkę lodów St. Helens, a przez okno wychodzące na wschód widać było biały trójkąt z góry Hood. Facet, który nie miał odpowiednich umiejętności, aby zostać profesorem Harvardu, jest dziś dyrektorem Knight Cancer Institute OHSU, nazwanym na cześć Phila Knighta, założyciela Nike i rodaka z Portland, oraz jego żony Penny, która w 2008 roku zobowiązała się 100 milionów dolarów na obiekt. „Brian Druker to geniusz i wizjoner” - powiedział wówczas Phil Knight.
Nadeszły zaszczytne nagrody, w tym najwyższa w branży amerykańska nagroda, Lasker-DeBakey Clinical Medical Research Award, którą Druker podzielił w 2009 r. Z Lydon i Sawyers. Z jego licznych występów w mediach nikt nie zmieniłby jego życia bardziej niż opowieść o nim w People, „The Miracle Worker”, opublikowana w lutym 2001 roku. Magazyn wysłał reporterkę o imieniu Alexandra Hardy, aby przesłuchała zabitego smoka lekarza z szpital w chmurach. Oboje pobrali się w 2002 roku i są rodzicami Holdena, Julii i Claire. Powiedział Druker: „Teraz mogę skupić się na rodzinie jako na priorytecie. Nie mogłem tego zrobić 10 lub 15 lat temu. ”
Dla niektórych obserwatorów bajka Gleevec wkrótce straciła swój blask. „Wonder Drug” na białaczkę cierpi na niepowodzenie ”, donosi Wall Street Journal w 2002 r., Kiedy niektórzy pacjenci stali się oporni na lek lub nie mogli go tolerować. Wydawało się też, że badacze spóźniają się z produkcją innych leków ukierunkowanych na oswajanie innych nowotworów, co podważa obietnicę strategii. Reporter Time napisał na blogu w 2006 r., Że Gleevec był „narkotykiem Kopciuszka” - szklanym pantoflem pasującym na jednego kandydata. Sawyers powiedział, że zmęczył się badaczami mówiącymi, że Gleevec był jednorazowym, szczęśliwym strzałem.
Koszt leku budzi kontrowersje od 1. dnia. Roczna podaż w Stanach Zjednoczonych wynosi obecnie około 50 000 USD, czyli około 140 USD na tabletkę dziennie. Jest to dwukrotność pierwotnego kosztu, który Vasella broniła jako „wysoka”, ale także „uczciwa”, ponieważ lek zapewnia pacjentom dobrą jakość życia, a przychody firmy gwarantują badania nad innymi lekami. (Zapytana o przyczyny podwyżki cen rzeczniczka Novartis odmówiła komentarza). W każdym razie lek, którego Novartis nie chciał opracować, ponieważ rynek był zbyt mały, stał się hitem. W 2010 r. Gleevec wygenerował 4, 3 mld USD sprzedaży na całym świecie - drugi pod względem przychodów lek firmy. Dla pewności Novartis dostarczył bezpłatne lub po obniżonych cenach leki pacjentom o niskich dochodach. W 2010 r. Firma pomogła około 5000 pacjentom z USA, przekazując im lek Gleevec i Tasigna o wartości 130 milionów dolarów, również lek Novartis.
Ale pacjenci, lekarze i inni od dawna narzekali na cenę Gleevca. W swojej książce z 2004 roku „ The Truth About the Drug Companies” Marcia Angell, była redaktorka New England Journal of Medicine, zasugerowała, że Novartis „dławi” pacjentów Gleevecowi. Ostatnio lekarze poinformowali, że pacjenci przestali przyjmować lek Gleevec, ponieważ nie mogli sobie na to pozwolić, pomimo programu pomocy firmy.
Druker, który powiedział, że jego laboratorium otrzymało fundusze na badania Novartis, ale ani on, ani OHSU nigdy nie otrzymali tantiem Gleevec, nie żałuje tego. „Powinna to być przystępna cena, która mieściłaby się w przedziale od 6 000 do 8 000 USD rocznie”, powiedział mi. „Firma nadal miałaby wiele zysków”. Kontynuował: „Wiele leków przeciwnowotworowych jest obecnie wycenianych znacznie poza dziedziną przystępności cenowej. Jako branża opieki zdrowotnej będziemy musieli sobie z tym poradzić ”.
Będzie wiele do czynienia: wygląda na to, że Gleevec był nie tylko szczęśliwym strzałem. Sam fakt, że naukowcy szybko zaprojektowali nowe leki, aby poradzić sobie z opornością na Gleevec, pokazuje, że coraz lepiej wiedzą, co robią, powiedział Sawyers, obecnie w Memorial Sloan-Kettering Cancer Center. Kierował grupą, która jako pierwsza wyjaśniła opór i była zaangażowana w rozwój Sprycela. „Dlaczego jestem taki optymistyczny?” - powiedział. „Znamy wroga i wiemy, jak go pokonać.”
Rzeczywiście, kilka terapii przeciwnowotworowych ukierunkowanych na enzymy uzyskało aprobatę FDA w następstwie Gleevca, w tym leki przeciwko konkretnym formom raka płuc i raka trzustki. A naukowcy twierdzą, że są bardzo podekscytowani terapiami w badaniach klinicznych. Wydaje się, że niektórzy pacjenci z czerniakiem, których choroba jest spowodowana znaną mutacją genetyczną, odnoszą znaczne korzyści z eksperymentalnego leku o nazwie PLX4032. Sawyers bada formę raka gruczołu krokowego pobudzonego przez zmutowany receptor hormonu i powiedział, że testy kliniczne leku (zwanego MDV3100) skierowanego przeciwko niemu są „ekscytujące”. Jedna analiza przemysłu farmaceutycznego szacuje, że firmy farmaceutyczne obecnie rozwijają się i testują 300 ukierunkowanych terapii raka molekularnego à la Gleevec.
Arul Chinnaiyan, patolog badawczy specjalizujący się w nowotworach na University of Michigan Medical School w Ann Arbor, jest szczery o wpływie Gleevca. „Próbujemy franczyzować jego sukces” - powiedział o swoich próbach zastosowania terapii celowanej w guzach litych, które są bardziej złożone niż CML. Każdy rodzaj guza litego może być napędzany przez wiele błędnych enzymów i receptorów - struktur białkowych, które przenoszą wiadomości chemiczne - a różnorodność mutacji może różnić się w zależności od osoby. Chinnaiyan himself has discovered two different mutant gene fusions analogous to BCR-ABL that appear to drive many prostate cancers. “The thought is if we know these are the molecular lesions, we'll be able to match the drug or combination of drugs appropriately, ” Chinnaiyan said.
W pewnym momencie zrozumiałem coś, co nazywa „spersonalizowaną onkologią” w pubie piwnym w Ann Arbor. Po drewnianym stole z bliznami, jedzący bekonowego cheeseburgera i popijając piwo, był 62-letni Jerry Mayfield, były żołnierz stanu Luizjana. W tym czasie u jego hematologa zdiagnozowano CML w 1999 r., Mayfield powiedział mu, że ma dwa do trzech lat życia. Mayfield zapytał, czy należy rozważyć eksperymentalne leki. Lekarz powiedział „nie”. Mayfield sprawdził Internet, dowiedział się o STI571 i nauczył się programowania komputerowego podczas obsługi nocnego biurka w komendzie policji w Monroe, stworzył stronę internetową newcmldrug.com, aby poinformować innych pacjentów. Gdyby słuchał swojego lekarza rodzinnego, Mayfield powiedział: „bez pytania nie byłoby mnie dzisiaj”.
Nadal prowadzi swoją stronę internetową, a obecnie mieszka w Bloomington w stanie Illinois. Był w Ann Arbor, aby zobaczyć się z Talpazem, który współpracował przy początkowych badaniach klinicznych Gleevec w Houston, ale przeniósł się na University of Michigan. Zajmował się Mayfield od ponad dekady, stosując kolejno ukierunkowane terapie, gdy Mayfield stał się oporny lub nie mógł ich już tolerować: Gleevec, Sprycel, Tasigna, bosutinib, a teraz ponatinib, kolejny eksperymentalny lek blokujący kinazę CML, ścigający się klinicznie próby.
Mayfield jest „chłopcem z plakatu w terapii CML”, powiedział mi Talpaz. „Ma się bardzo dobrze”.
Ponad głośną muzyką pubu Mayfield powiedział o swoim genie BCR-ABL: „Miałem mutację G250E - mam mutację G250E - dlatego stałem się odporny na Gleevec”.
Jego uwaga brzmiała jak coś z wehikułu czasu zaprogramowanego na lata lub dekady, kiedy ludzie będą nonszalancko opowiadać o swoich śmiertelnych mutacjach genetycznych i lekach, które ich utrudniają. To obraz, który często wywołuje Drukarka. „W niezbyt odległej przyszłości”, napisał, przyjmując nagrodę Lasker-DeBakey, „klinicyści będą mogli dokładnie analizować guzy poszczególnych osób pod kątem wad molekularnych i dopasować każdą osobę do konkretnych, skutecznych terapii, które zapewnią trwałą odpowiedź przy minimalnej toksyczności. ”
Drukarka nigdy nie traktowała Mayfielda, ale skonsultowała się z nim. „Dziesięć lat temu siedziałem w moim lokalnym gabinecie onkologa i zadzwonił mój telefon” - powiedział Mayfield. „To był dr Druker. Wysłałem mu e-mail. Byłem oszołomiony. Powiedziałem swojemu onkologowi: „Nieuprzejmie jest odpowiadać na to wezwanie, ale to mój bohater”. To taki miły, delikatny i oddany człowiek, nie mniej arogancki. Uratował tak wiele istnień ludzkich. Wszyscy w kraju powinni znać jego imię. To rodzaj idola, który powinniśmy mieć, zamiast gwiazd sportu.
Strona internetowa Mayfield ma „album uznania” poświęcony Drukerowi, pełen hołdów od pacjentów z CML. Migawka po migawce pokazuje osoby uśmiechnięte w jasnym świetle słonecznym - wędrówki, sadzenie drzew, picie szampana - ludzie, którzy czuli się poruszeni, mówiąc, że są mu winni, cóż, wszystko . Złożyli dziesiątki wierszy i limeryków, takich jak ten autorstwa pacjentki o imieniu Jane Graham:
Był kiedyś lekarz o imieniu Brian
Na czyich badaniach wszyscy polegaliśmy
Wiedział, że jesteśmy chorzy
Więc zrobił nam pigułkę,
A teraz nie planujemy śmierci.
Wbrew oczekiwaniom
Druker spotkał się z LaDonna Lopossa w sali egzaminacyjnej, w której co czwartek widzi badanych pacjentów. George, który twierdzi, że LaDonna ma „niezatapialną cechę Molly Brown”, zepchnął ją z Battle Ground za jej kontrolę. Usiadła na krześle, a Druker, ubrany w luźny granatowy garnitur, opierał się o krawędź stołu do badań. „Nie byłoby mnie bez ciebie” - powiedziała LaDonna (być może dla mojej korzyści).
„Cóż, jesteś tutaj” - powiedział Druker. "Dobrze ci idzie."
„Lubię tańczyć na ulicach”.
"Świetny. Jakieś problemy?"
"Nie. Po prostu mam wysypkę. ”
„Kiedy to się zaczęło?”
„Jakieś dziesięć tygodni temu.”
Zapytał o wysypkę, a później opuściłem pokój, żeby mógł ją zbadać.
„Nadal pracujesz w banku żywności?” - zapytał.
„Robię jeden dzień w tygodniu”.
„Jak leci?”
"Przerażający."
„Jak twoja energia?”
„Moja energia jest niska. Ale mój mózg jest aktywny. ”
„Robisz po prostu spektakularnie, jeśli chodzi o białaczkę”.
"Wiem to. Mogę to poczuć."
"Co jeszcze? Pytania do mnie?
„Jadę jutro na wycieczkę”.
"Do?"
„San Diego i Knott's Berry Farm ze wszystkimi moimi wnukami.” Zaktualizowała ich postępy, a Druker wyrecytował ich wiek, jakby chciał sprawdzić, czy ma rację. Kiedy przemawia do naukowców na profesjonalnych konferencjach, często pokazuje zdjęcia LaDonna i jej wnuków. Wbrew wszelkim oczekiwaniom, ona obserwuje, jak dorastają jej prawnuki.
„Mam takie cudowne życie” - powiedziała LaDonna, łzawiąc. „I nie chciałem tego. Powiedziałem lekarzom: „Nie rób mi więcej”. ”
Wytarła oczy chusteczką i wspomniała o swojej pierwszej wizycie w klinice w 2000 roku, kiedy ledwo udało jej się przejść przez drzwi. „To było dawno temu”, powiedziała do nikogo szczególnie.
Następnie do Drukera powiedziała: „Ale szybko minęło, prawda?”
„Nie?” Powiedział.
Terence Monmaney po raz pierwszy napisał dla Smithsonian w 1985 roku. Jest redaktorem naczelnym. Robbie McClaran z Portland sfotografował swoje adoptowane miasto rodzinne do wydania z listopada 2010 roku.








 LaDonna Lapossa uderza pozę na swojej działce na cmentarzu w 2000 roku. (Dzięki uprzejmości Ladonna Lapossa)
LaDonna Lapossa uderza pozę na swojej działce na cmentarzu w 2000 roku. (Dzięki uprzejmości Ladonna Lapossa)  „Dopiero zaczynamy dopasowywać pacjentów do odpowiedniego leku i obserwujemy szybką poprawę” - mówi dr Brian Druker. (Robbie McClaran)
„Dopiero zaczynamy dopasowywać pacjentów do odpowiedniego leku i obserwujemy szybką poprawę” - mówi dr Brian Druker. (Robbie McClaran)  Jerry Mayfield, u którego w 1999 r. Zdiagnozowano białaczkę, powiedziano mu, że ma dwa do trzech lat życia. „Miałem nadzieję ujrzeć tysiąclecie” - mówi były żołnierz stanu, który stworzył stronę internetową o nowej terapii, którą zaczął. (Tim Klein)
Jerry Mayfield, u którego w 1999 r. Zdiagnozowano białaczkę, powiedziano mu, że ma dwa do trzech lat życia. „Miałem nadzieję ujrzeć tysiąclecie” - mówi były żołnierz stanu, który stworzył stronę internetową o nowej terapii, którą zaczął. (Tim Klein)  Ciężko chora na białaczkę Suzan McNamara zaczęła brać lek Gleevec w 2000 roku. Dziesięć lat później wyszła za mąż na Hawajach. (Dzięki uprzejmości Suzan McNamara)
Ciężko chora na białaczkę Suzan McNamara zaczęła brać lek Gleevec w 2000 roku. Dziesięć lat później wyszła za mąż na Hawajach. (Dzięki uprzejmości Suzan McNamara)  „To bardzo ekscytujący czas na badania nad rakiem” - mówi Arul Chinnaiyan (tutaj, w swoim laboratorium na Uniwersytecie Michigan), który jest zainspirowany sukcesem Gleevca. „Jestem bardzo optymistyczną technologią do tego stopnia, że możemy znaleźć genetyczne pochodzenie różnych nowotworów”. (Fabrizio Costantini / Aurora Select)
„To bardzo ekscytujący czas na badania nad rakiem” - mówi Arul Chinnaiyan (tutaj, w swoim laboratorium na Uniwersytecie Michigan), który jest zainspirowany sukcesem Gleevca. „Jestem bardzo optymistyczną technologią do tego stopnia, że możemy znaleźć genetyczne pochodzenie różnych nowotworów”. (Fabrizio Costantini / Aurora Select)  „Kiedy już prawie umarłeś, masz inne spojrzenie na życie”, mówi Lopossa w swoim domu z mężem, Georgem. „Doceniasz to, co mamy”. (Robbie McClaran)
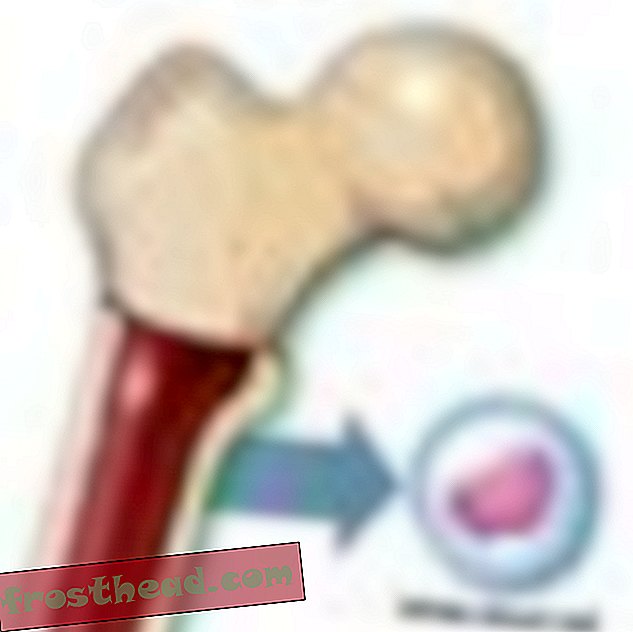
„Kiedy już prawie umarłeś, masz inne spojrzenie na życie”, mówi Lopossa w swoim domu z mężem, Georgem. „Doceniasz to, co mamy”. (Robbie McClaran) 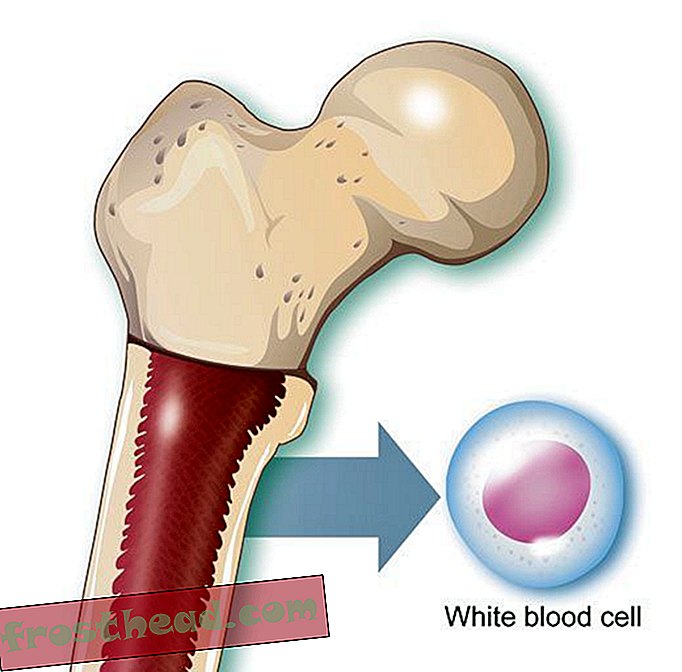 Przyczyny śmiertelnego raka krwi br> Produkcja komórek br> Niektóre komórki macierzyste wytwarzają w szpiku kostnym czerwone ciałka przenoszące tlen, podczas gdy inne tworzą białe krwinki lub leukocyty, które w większości leczą urazy i zwalczają infekcje. Zarażona rana jest zabarwiona na biało głównie przez leukocyty. (Ilustracja do Smithsona )
Przyczyny śmiertelnego raka krwi br> Produkcja komórek br> Niektóre komórki macierzyste wytwarzają w szpiku kostnym czerwone ciałka przenoszące tlen, podczas gdy inne tworzą białe krwinki lub leukocyty, które w większości leczą urazy i zwalczają infekcje. Zarażona rana jest zabarwiona na biało głównie przez leukocyty. (Ilustracja do Smithsona ) 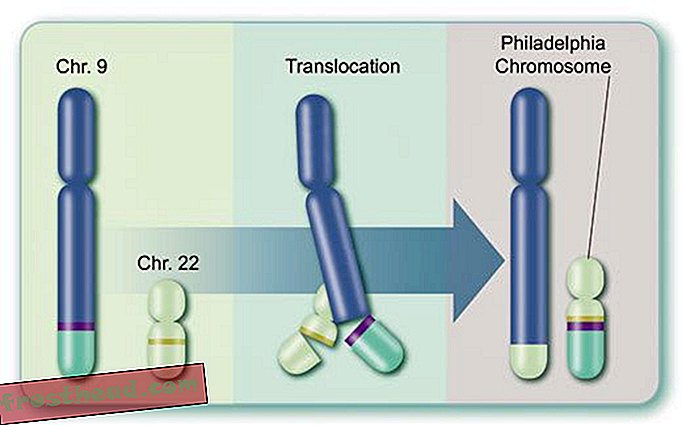 Chromosomy przypadkowo krzyżują się ze sobą > CML powstaje, gdy komórka macierzysta ulega błędzie podczas podziału. Zamiast 23 par chromosomów dokładnie powielonych, bity chromosomów nr 9 i nr 22 zmieniają miejsca, tworząc nieprawidłowy „chromosom Philadelphia” niosący zmutowany gen. (Ilustracja do Smithsona )
Chromosomy przypadkowo krzyżują się ze sobą > CML powstaje, gdy komórka macierzysta ulega błędzie podczas podziału. Zamiast 23 par chromosomów dokładnie powielonych, bity chromosomów nr 9 i nr 22 zmieniają miejsca, tworząc nieprawidłowy „chromosom Philadelphia” niosący zmutowany gen. (Ilustracja do Smithsona ) 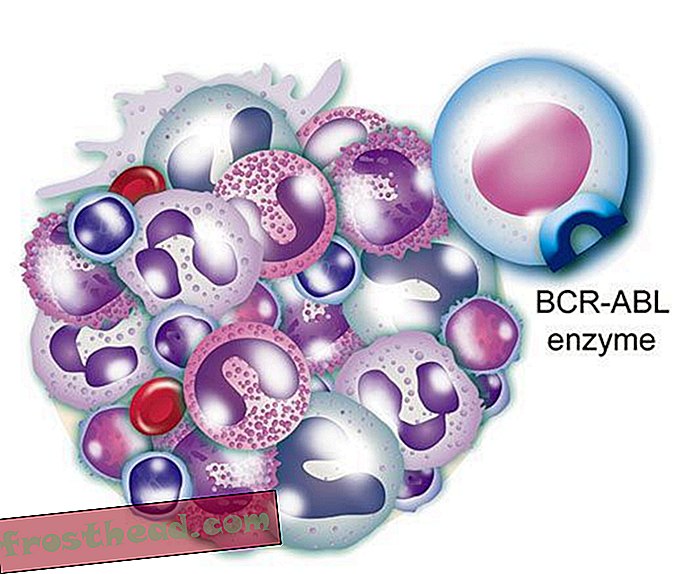 Lek, który uderza w cel br> Zmutowany gen wytwarza renegatyczny enzym o tej samej nazwie, BCR-ABL. Pobudza to niekontrolowany podział białych krwinek lub białaczkę. (Ilustracja do Smithsona )
Lek, który uderza w cel br> Zmutowany gen wytwarza renegatyczny enzym o tej samej nazwie, BCR-ABL. Pobudza to niekontrolowany podział białych krwinek lub białaczkę. (Ilustracja do Smithsona ) 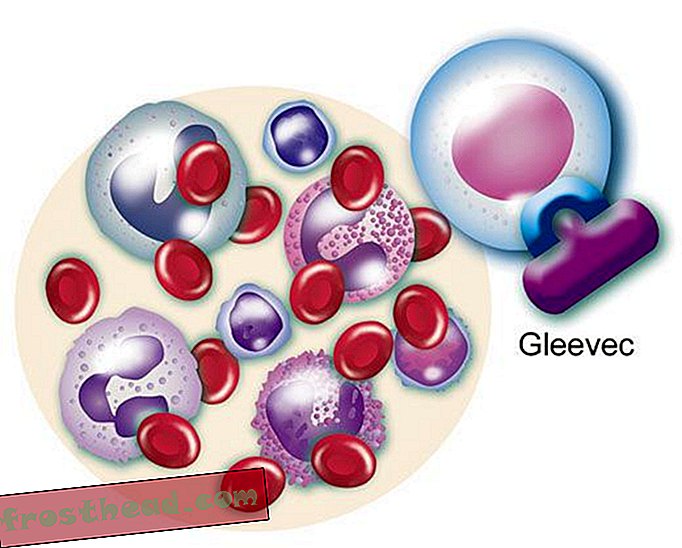 Lek, który uderza w cel Br> Lek CML Gleevec blokuje enzymatyczną blokadę i kluczowanie w komórce, przywracając prawidłowy wzrost białych krwinek. (Ilustracja do Smithsona )
Lek, który uderza w cel Br> Lek CML Gleevec blokuje enzymatyczną blokadę i kluczowanie w komórce, przywracając prawidłowy wzrost białych krwinek. (Ilustracja do Smithsona )

